
(або заповненої повітрям).
Нітроген
Nitrogenium
| 7 | Нітроген |
| N | 14,007 |
| 1s22s22p3 | |
Нітроген утворює одну просту речовину азот N2.

ІСТОРІЯ ВІДКРИТТЯ ТА ДОСЛІДЖЕННЯ.
 Генрі Кавендіш (1731 – 1810) |
 Джозеф Прістлі (1733 – 1804) |
 Карл Вільгельм Шеєле (1742 – 1786) |
У 1772 році Генрі Кавендіш провів наступний дослід: він багато разів пропускав повітря над розпеченим вугіллям, потім обробляв його лугом, в результаті виходив залишок, який Кавендіш назвав задушливим (або мефітичним) повітрям. З позицій сучасної хімії зрозуміло, що в реакції з розпеченим вугіллям кисень повітря зв'язувався у вуглекислий газ, який потім поглинався лугом. При цьому залишок газу представляв собою здебільшого азот. Таким чином, Кавендіш виділив азот, але не зумів зрозуміти, що це нова проста речовина (хімічний елемент). У тому ж році Кавендіш повідомив про цей дослід Джозефу Прістлі.
Цікавий той факт, що він зумів зв'язати азот з киснем за допомогою розрядів електричного струму, а після поглинання оксидів Нітрогену у залишку отримав невелику кількість газу, абсолютно інертного, хоча, як і у випадку з азотом, не зміг зрозуміти, що виділив новий хімічний елемент — інертний газ аргон.
Прістлі в цей час проводив серію експериментів, в яких також зв'язував кисень повітря і видаляв отриманий вуглекислий газ, тобто також отримував азот, проте, будучи прихильником панівної в ті часи теорії флогістону, зовсім невірно розтлумачив отримані результати (на його думку, процес був протилежним — не кисень видалявся з газової суміші, а навпаки, в результаті випалу повітря насичується флогістоном; залишок повітря (азот) він і назвав насиченим флогістоном, тобто флогістованим). Очевидно, що і Прістлі, хоча і зміг виділити азот, не зумів зрозуміти суті свого відкриття, тому й не вважається першовідкривачем Нітрогену (азоту).
Одночасно схожі експерименти з тим же результатом проводив і Карл Шеєле.
У 1772 році азот (під назвою «зіпсованого повітря») як просту речовину описав Даніель Резерфорд, він опублікував магістерську дисертацію, де вказав основні властивості азоту (не реагує з лугами, не підтримує горіння, непридатний для дихання). Саме Даніель Резерфорд і вважається першовідкривачем азоту. Однак і Резерфорд був прихильником флогістонної теорії, тому також не зміг зрозуміти, що ж він виділив. Таким чином, чітко визначити першовідкривача Нітрогену неможливо.

Лавуазьє в 1776 – 1777 рр. детально досліджував склад атмосферного повітря і встановив, що 4/5 його об'єму складаються з задушливого газу (Аir mofette — атмосферний мофетт, або просто Mofett).
Назву Азот (від грец. ἀζωτος — позбавлений життя), замість попередніх назв («флогістоване», «мефітичне» і «зіпсоване» повітря) запропонував у 1787 Антуан Лавуазьє, який на той час у складі групи інших французьких вчених розробляв принципи хімічної номенклатури, в тому ж році цю пропозицію опубліковано в праці «Метод хімічної номенклатури».

Існує й інша версія. Слово «азот» придумано не Лавуазьє і не його колегами по номенклатурній комісії; воно увійшло в алхімічну літературу вже в ранньому середньовіччі і вживалось для позначення «первинної матерії металів», яку вважали «альфою і омегою» всього сущого. Це вираз запозичений з Апокаліпсису: «Я Альфа і Омега, початок і кінець» (Об'явл. 1:8-10). Слово складено з початкових і кінцевих літер алфавітів трьох мов — латинської, грецької та староєврейської, — що вважалися «священними», оскільки, згідно з Євангеліями, напис на хресті при розп'ятті Ісуса Христа була зроблена на цих мовах (а, альфа, алеф і зет, омега, тав — AAAZOTH). Укладачі нової хімічної номенклатури добре знали про існування цього слова; ініціатор її створення Гітон де Морво зазначав у своїй «Методичної енциклопедії» (1786) алхімічне значення терміну.
Можливо, слово «азот» походить від одного з двох арабських слів — або від слова «аз-зат» («сутність» або «внутрішня реальність»), або від слова «зібак» («ртуть»).
Назва «азот», крім французької та російської, прийнята в італійській, турецькій та ряді слов'янських мов, а також в багатьох мовах народів колишнього СРСР.
На латині азот називається nitrogenium, тобто «той, що породжує селітру», звідси символ N. Цю назву у французькій формі nitrogène запропонував французький хімік Ж. Шапталь в 1790 році у своїй книзі «Елементи хімії», однак у французькій мові вона не прижилась, на відміну від багатьох інших мов (зокрема, англійської, іспанської, угорської, норвезької), де назва є похідним від цього слова.
,_comte_de_Chanteloup.jpg)
В Україні в 1995 році було запроваджено назву для елемента № 7 Нітроген (ДСТУ 2439-94 "Державний стандарт України "Елементи хімічні та речовини прості" чинний від 01.01.1995 року). Назву азот залишено для позначення простої речовини N2.
Поза межами Землі Нітроген виявлений в газових туманностях, сонячній атмосфері, на Урані, Нептуні, у міжзоряному просторі та ін. Нітроген — четвертий за поширеністю елемент Сонячної системи (після Гідрогену, Гелію і Оксигену).
Загальний вміст Нітрогену в земній корі становить 1·10-2% за масою. Основна його маса знаходиться в повітрі, у вільному молекулярному вигляді — N2. Сухе повітря містить в середньому 78,09% за об'ємом (або 75,6% за масою) вільного азоту, що відповідає загальній масі 4·1015 т.

У відносно малих кількостях вільний азот перебуває в розчиненому стані у водах океанів. У вигляді сполук з іншими елементами (зв'язаний Нітроген) входить в склад всіх рослинних і тваринних організмів.

Потужні родовища Нітрогену у вигляді так званої чилійської селітри відомі лише в Чилі (Південна Америка).

Крім того, невеликі кількості Нітрогену містяться в ґрунті, головним чином у вигляді органічних сполук і солей нітратної кислоти. У земній корі Нітроген утворює три основні типи мінералів, які містять йони CN-, NO3-, NH4+. Промислове значення має натрієва селітра NaNO3, великі поклади якої є в Чилі та калійна селітра KNO3 (найбільші поклади в Індії).
 Чилійська селітра NaNO3 (натрієва селітра, нітронатрит). |
 Індійська селітра KNO3 (калієва селітра, нітрокаліт). |
 Нашатир NH4Cl (скелетні кристали до 10 см). Урочище Кухи-Малик, Фан-Ягнобське родовище вугілля, поблизу к. Рават, р. Ягноб, Таджикистан. Зразки: ДГМ ім. В.І. Вернадського. Фото: © А. Євсеєв |
|
В промисловості молекулярний азот отримують фракційною перегонкою рідкого повітря. Цим методом можна отримати і «атмосферний азот» (так званий «повітряний», або «атмосферний» азот — це суміш азоту з благородними газами). Також широко застосовуються азотні установки і станції, в яких використовується метод адсорбційного і мембранного газорозділення.
В лабораторіях азот можна одержати:
Реакція екзотермічна, йде з виділенням 80 ккал (335 кДж), тому потрібне охолоджування посудини при її протіканні (хоча для початку реакції потрібно нагрівання амоній нітриту). Практично цю реакцію виконують, додаючи по краплях насичений розчин натрій нітриту в нагрітий насичений розчин амоній сульфату, при цьому амоній нітрит, який утворюється в результаті обмінної реакції миттєво розкладається. Газ, що виділяється при цьому, забруднений аміаком, нітроген(I) оксидом і киснем, від яких його очищають, послідовно пропускаючи через розчини сульфатної кислоти, ферум(II) сульфату і над розпеченою міддю. Потім азот осушують.
Аміак беруть з його насиченого розчину при нагріванні. Кількість CuO в 2 рази більше розрахункового. Безпосередньо перед застосуванням азот очищають від домішок кисню і аміаку пропусканням над міддю і її купрум(II) оксидом (теж ∼700 °C), потім сушать концентрованою сірчаною кислотою і сухим лугом. Процес відбувається досить повільно, але газ виходить досить чистий.
ВІДЕО РЕАКЦІЇ МІЖ АМОНІЙ ХЛОРИДОМ ТА НАТРІЙ НІТРИТОМ
Переглянути відео
Газоподібний азот зберігають у стальних балонах. Балони з азотом пофарбовані в чорний колір, мають напис жовтого кольору.

Літр рідкого азоту, випаровуючись і нагріваючись до 20 °C, утворює приблизно 700 літрів газу. З цієї причини рідкий азот зберігають у спеціальних посудинах Дьюара з вакуумною ізоляцією відкритого типу або кріогенних ємностях під тиском.
Алотропія та ФІЗИЧНІ ВЛАСТИВОСТІ.
Нітроген за звичайних умов утворює лише одну просту речовину – азот (N2).
Азот — безбарвний газ без запаху і смаку. Густина 1,2506 кг/м3 (за н. у.). Азот не підтримує ні дихання, ні горіння. У воді розчиняється мало. Його розчинність при 20 °C становить 1,54 см3 на 100 г води.
Під дією електричного розряду випромінює світло.

Кипить при температурі -195,8 °C. Азот у рідкому стані — безбарвна, рухлива, як вода, рідина. Густина рідкого азоту 808 кг/м3. При контакті з повітрям поглинає з нього кисень.

При -209,86 °C азот переходить у твердий стан у вигляді сніговидної маси чи великих білосніжних кристалів. При контакті з повітрям поглинає з нього кисень, при цьому плавиться, з утворенням розчину кисню в азоті.

ВІДЕО ОДЕРЖАННЯ АЗОТУ В ТВЕРДОМУ СТАНІ
Переглянути відео
Відомі три кристалічні модифікації твердого азоту. В інтервалі 36,61…63,29 К існує фаза β-N2 з щільним гексагональним упакуванням. За температури нижчої від 36,61 К стійкою є фаза α-N2 з кубічною ґраткою. Під тиском понад 3500 атмосфер і температурі нижчій від 83 K утворюється гексагональна фаза γ-N2.
Азот хімічно інертна речовина. Це зумовлено дуже високою енергією потрійного зв'язку в молекулі N2.
З огляду на свою значну інертність азот при звичайних умовах реагує тільки з літієм:
ВІДЕО: Взаємодія азоту з літієм при нагріванні.
Переглянути відео
При нагріванні він реагує з деякими іншими металами і неметалами, також утворюючи нітриди:
ВІДЕО: Взаємодія азоту з магнієм
Переглянути відео

Аморфний бор нітрид (BN)
При високій температурі, високому тиску і наявності каталізатора азот взаємодіє з воднем з утворенням амоніаку (амоніачний спосіб фіксації азоту):
ВІДЕО: Взаємодія азоту з воднем
Переглянути відео
При температурі електричної іскри (понад 3000 °C) азот реагує з киснем, утворюючи нестійкий при високій температурі нітроген(II) оксид NO за реакцією:
У природі ця реакція відбувається при грозових розрядах.

Існує і ще один, менш поширений спосіб промислового зв'язування атмосферного азоту — ціанамідний метод, заснований на реакції карбіду кальцію з азотом при 1000 °C. Реакція відбувається за рівнянням:
Газоподібний азот
Промислові застосування газоподібного азоту обумовлені його інертними властивостями.
Азот широко використовується у процедур підготовки зразків для хімічного аналізу. Він використовується для концентрування та зменшення об'єму рідких проб. Напрямлений під тиском потік азоту перпендикулярно до поверхні рідини дозволяє випаровувати розчинник, залишаючи розчинені речовини і невипарений розчинник.
Азот може бути використаний в якості заміни або в комбінації з діоксидом вуглецю для підвищення тиску діжок деяких сортів пива, особливо стаутів і британського елю, завдяки дрібнішим бульбашкам, які він виробляє, що робить пиво більш приємним та якісним.
Як заміна двоокису вуглецю в якості основного джерела живлення для пейнтбольних рушниць. Азот повинен бути при більшому тиску, ніж CO2, N2 робить танки рушниць важчими і дорожчими.
Азот вибраний як інертний задушливий газ, і знаходиться на розгляді в якості заміни для смертельної ін'єкції в Оклахомі. Азот запропоновано для здійсьнення евтаназії Філіпом Нітшке.

У нафтохімії азот застосовується для продування резервуарів і трубопроводів, перевірки роботи трубопроводів під тиском, збільшення вироблення родовищ. У гірничодобувній справі азот може використовуватися для створення в шахтах вибухобезпечного середовища, для розпирання пластів породи.
Велика частина одержуваного в промисловості азоту застосовується на виробництві аміаку.
Рідкий азот
У техніці і на виробництві:
Кулінарне використання рідкого азоту вперше згадується в 1890 році в книзі рецептів під назвою Fancy Ices авторством пані Агнес Маршалл.




У медицині:

|
Кріокамера -110 °C |
Підготовка пацієнта до «кріотерапії» |
Азотне пожежогасіння, поряд з вуглекислотним, — найбільш ефективний спосіб гасіння пожеж з точки зору збереження цінностей.
Кріоніка — збереження у стані глибокого охолодження («кріоконсервація», «кріозбереження») тіл людей і тварин в надії на те, що в майбутньому їх вдасться оживити і при необхідності — вилікувати. Іноді кріоконсервації піддають тільки голову або головний мозок організму, що зберігається.
Біологічна роль та фізіологічна дія
Нітроген є важливим будівельним блоком амінокислот і нуклеїнових кислот, необхідних для життя на Землі.
Нітроген є хімічним елементом, необхідним для існування тварин і рослин, він входить до складу білків (16 – 18% по масі), амінокислот, нуклеїнових кислот, нуклеопротеїдів, хлорофілу, гемоглобіну та ін. У складі живих клітин за кількістю атомів Нітрогену близько 2 % , по масовій частці – близько 2,5% (четверте місце після Гідрогену, Карбону і Оксигену). У зв'язку з цим значна кількість Нітрогену міститься в живих організмах, «мертвій органіці» і дисперсній речовині морів і океанів. Ця кількість оцінюється приблизно в 1,9 · 1011 т. У результаті процесів гниття і розкладання нітрогенвмісної органіки, за умови сприятливих факторів навколишнього середовища, можуть утворитися природні поклади корисних копалин, що містять Нітроген, наприклад, «чилійська селітра» (нітрат натрію з домішками інших сполук), норвезька, індійська селітри.
Незважаючи на важливість Нітрогену для живих організмів, ні рослини, ні тварини не можуть засвоювати атмосферний азот. Деякі бактерії, проте, мають фермент нітрогеназу, за допомогою якого азот фіксується і далі засвоюється рослинами. Не всі речовини, до складу яких входить Нітроген, сприяють розвитку рослин. Амінні солі феноксиоцтової і трихлорфеноксиоцтової кислот — гербіциди. Перша пригнічує ріст бур'янів на полях злакових культур, друга застосовується для очищення земель під ріллю — знищує дрібні дерева і чагарники.
Колообіг Нітрогену у природі.
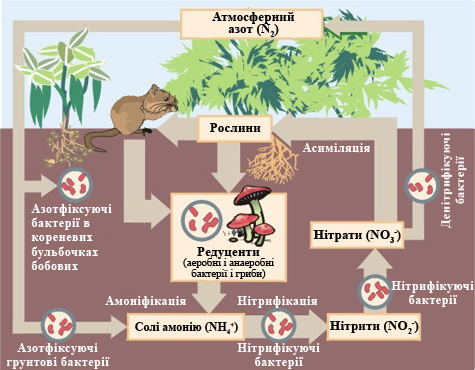
Фіксація атмосферного азоту в природі відбувається за двома основними напрямками — абіогенному і біогенному. Перший шлях включає головним чином реакції азоту з киснем. Так як азот хімічно дуже інертний, для окиснення потрібні великі кількості енергії (високі температури). Ці умови досягаються при розрядах блискавок, коли температура досягає 25000 °C і більше. При цьому відбувається утворення різних оксидів азоту. Існує також імовірність, що абіотична фіксація відбувається в результаті фотокаталітичних реакцій на поверхні напівпровідників або широкосмугових діелектриків (пісок пустель).
Проте основна частина молекулярного азоту (близько 1,4 · 108 т/рік) фіксується біотичним шляхом. Довгий час вважалося, що зв'язувати молекулярний азот можуть тільки невелика кількість видів мікроорганізмів (хоча і широко розповсюджених на поверхні Землі): бактерії Azotobacter і Clostridium, бульбочкові бактерії бобових рослин Rhizobium, ціанобактерії Anabaena, Nostoc та ін. Зараз відомо, що цією здатністю володіють багато інших організмів у воді та грунті, наприклад, актиноміцети в бульбах вільхи та інших дерев (всього 160 видів). Всі вони перетворюють молекулярний азот в сполуки амонію (NH4+). Цей процес вимагає значних витрат енергії (для фіксації 1 г атмосферного азоту бактерії в клубеньках бобових витрачають порядку 167,5 кДж, тобто окислюють приблизно 10 г глюкози). Таким чином, видно взаємна користь від симбіозу рослин і азотфіксуючих бактерій — перші надають другим «місце для проживання» і постачають отриманим в результаті фотосинтезу «паливом» — глюкозою, другі забезпечують необхідний рослинам Нітроген в засвоюваній ними формі.
Нітроген у формі амоніаку і сполук амонію, що утворюється в процесах біогенної азотфіксації, швидко окиснюється до нітратів і нітритів (цей процес носить назву нітрифікації). Останні, не зв'язані тканинами рослин (і далі по харчовому ланцюгу травоїдними і хижаками), недовго залишаються в грунті. Більшість нітратів і нітритів добре розчинні, тому вони змиваються водою і, врешті-решт, потрапляють у світовий океан (цей потік оцінюється в 2,5—8 · 107 т/рік).
Нітроген, включений в тканини рослин і тварин, після їх загибелі піддається амоніфікації (розкладанню складних сполук, що містять Нітроген, з виділенням амоніаку і йонів амонію) і денітрифікації, тобто виділенню атомарного Нітрогену, а також його оксидів. Ці процеси повністю відбуваються завдяки діяльності мікроорганізмів в аеробних і анаеробних умовах.
За відсутності діяльності людини процеси зв'язування азоту і нітрифікації практично повністю врівноважені протилежними реакціями денітрифікації. Частина азоту надходить в атмосферу з мантії з виверженнями вулканів, частина міцно фіксується в грунтах і глинистих мінералах, крім того, постійно йде витік азоту з верхніх шарів атмосфери в міжпланетний простір.
Токсикологія азоту та сполук Нітрогену
Сам по собі атмосферний азот досить інертний, щоб безпосередньо впливати на організм людини і ссавців. Тим не менш, при підвищеному тиску він викликає наркоз, сп'яніння або ядуху (при нестачі кисню); при швидкому зниженні тиску азот викликає кесонну хворобу.
Багато сполук Нітрогену дуже активні і, нерідко, токсичні.