
Кисень не має забарвлення, тому ампула з цим газом виглядає порожньою
(або заповненої повітрям).
ГІДРОГЕН
Hydrogenium
| 1 | Гідроген |
| H | 1,0079 |
| 1s1 | |
Гідроген утворює просту речовину водень – H2.

Кисень не має забарвлення, тому ампула з цим газом виглядає порожньою
(або заповненої повітрям).
ІСТОРІЯ ВІДКРИТТЯ ТА ДОСЛІДЖЕННЯ.
Водень відомий досить давно. Його виділяли дією кислот на метали та спостерігали вибухи гримучого газу Парацельс, Бойль, Лемері та інші вчені XV1–XVIII століть.
 Філіп Ауреол Теофраст Бомбаст фон Гогенгайм (Парацельс) (1493 – 1541) |
 Роберт Бойль (1627 – 1691) |
 Нікола Лемері (1645 – 1715) |
Проте його вважали "вільним флонгітоном". Так, Михайло Васильович Ломоносов у своїй дисертації описує методи одержання водню ("горючої пари" - vapor inflammabilis) та висуває гіпотезу про те що цей газ є флонгістоном.

Михайло Васильович Ломоносов
(1711 – 1765)
Англійський фізик і хімік Генрі Кавендіш у 1766 році вперше не лише отримав водень, а й дослідив його властивості. Він помітив, що при горінні водню утворюється вода. саме тому Г. Кавендішу приписують відкриття водню та Гідрогену. Проте теорія флонгістону завадила йому зробити правильнв висновки. Пізніше, у 1779 році, досліджуючи водень, французький вчений Антуан Лоран Лавуазьє остаточно встановив склад води, а одну із її складових частин назвав Hydrogene.

Генри Кавендиш
(1731–1810)
Номенклатурна комісія в 1787 році прийняла цю назву, як похідну від грецьких гідро – вода та геннао – народжую.
Ізотопи Гідрогену були відкриті у 30-х роках минулого століття й відразу ж набули великого значення у науці й техніці. В кінці 1931 року Юрі, Брікведд та Мерфі дослідили залишок після довгого випарювання рідкого водню та виявили в ньому важкий Гідроген з масовим числом 2. Цей ізотоп назвали Дейтерієм (Deuterium, D) , від грецького деутрос – другий.
 Гарольд Клейтон Юрі (1893 – 1941) |
 Фердінанд Брікведд (1903 – 1989) |
 Джордж Мозлі Мерфі (1903 – 1968) |
Через чотири роки після цього, у воді , яка була піддана довготривалому електролізу, був виявлений ще один більш важкий ізотоп Гідрогену (3H), який назвали Тритієм, від грецького тритос – третій.
Тритій відкритий англійськими вченими Ернестом Резерфордом, Маркусом Оліфантом і Паулем Хартеком в 1934 році.
 Ернест Резерфорд (1871 – 1937) |
 Марк (Маркус Лоренс Елвін) Оліфант (1901 – 2000) |
 Пауль Хартек (1902 – 1985) |
Назва Гідроген походить від від грецьких слів: ὕδωρ — вода та γενναω — народжую, — «той, що народжує воду». Українська назва водень також відображає входження елементу до складу води.
Ядро протію містить один протон, дейтерію – два протони, тритію – три, звідси і назви ізотопів.
15 червня 1933 року Юрі, Мерфі і Брікведд направили лист редактору наукового журналу «The Journal of Chemical Physics», в якому запропонували назви для ізотопів Гідрогену – Протій (англ. Protium), Дейтерій (англ. Deuterium) і Тритій (англ. Tritium; в разі його відкриття, оскільки на той момент тритій ще не був відкритий), в листі вони зазначали, що утворили свої перші дві назви від грецьких слів «protos» («перший») і «deuteros» («другий»).
Назва третього ізотопу походить від грецького слова τρίτος (tritos) означає "третій".
Гідроген — найбільш розповсюджений елемент у Всесвіті. На його долю припадає 88,6% всіх атомів. Таким чином, водень — основна складова частина зірок та міжзоряного газу. Близько половини маси Сонця та зірок припадає на Гідроген.
 NGC 604, гігантська область іонізованого водню в Галактиці Трикутника. |
 Водень входить до складу Сонця. Фотографія Сонця, отримана Обсерваторією сонячної динаміки НАСА. |
В земній корі міститься 0,15% Гідрогену за масою. Гідроген входить до складу основної речовини Землі — води.

Тихий океан із космосу. Більша частина
поверхні Землі покрита водою.
Гідроген входить до складу вугілля, нафти, природного газу, глини, а також всієї біосфери — рослин та тварин. 16% всіх атомів на Землі припадає на атоми Гідрогену. У вільному вигляді він зустрічається дуже рідко — в вулканічних та інших природних газах.
 Кам'яне вугілля. |
 Зразок сирої нафти (геологічний музей А. А. Штукенберга). |
 Горіння природного газу. |
 Каолініт — складова глини (Al2O3·2SiO2·2H2O). |

|
 Виверження вулкана Стромболі. Острів Стромболі, на північ від Сицилії. |
Водень добувають:
В промисловості.
1) Електроліз водних розчинів солей:

Завод із виробництва каустичної соди і хлору та водню Буна в Шкопау 1953 р.
2) Пропускання парів води над розжареним коксом при температурі близько 1000 °C:

Газифікація вугілля на заводі в місті Тампа (США, штат Флорида), для виробництва водню і електроенергії.
Із природного газу.
3) Конверсія з водяною парою:
4) Каталітичне окиснення киснем:
5) Крекинг і риформінг вуглеводнів в процесі переробки нафти.
Наприклад:
|
Крекінг: C8H18 —→ t C8H16 + H2 |
Риформінг: Дегідрування нафтенових вуглевонів: С6H12 → C6H6 + 3H2 Ароматизація алканів: C6H14 → C6H6 + 4H2 |

Типовий блок каталітичного крекінгу на нафтопереробному заводі.
6) Електроліз води.
Електроліз води – це електролітичний процес, в якому проходження електричного струму призводить до розкладання води на газоподібні кисень і водень.
Джерело постійного електричного струму підключене до двох електродів або двох пластин (зазвичай виготовляють з деякого інертного металу, такого як платина, нержавіюча сталь або іридій), які поміщені в воду. Водень з'явиться на катоді, а кисень – на аноді.
Електроліз чистої води вимагає надлишкової енергії у вигляді перенапруги для подолання різних бар'єрів активації. Без надлишкової енергії електроліз чистої води проходить дуже повільно або й зовсім не відбувається. Це спричинено обмеженою самостійною іонізацію води. Чиста вода має електричну провідність близько однієї мільйонної в морській воді. Ефективність електролізу збільшується за рахунок додавання електроліту (наприклад, солі, з кислоти чи основи) і використання електрокаталізаторів.
У чистій воді на негативно зарядженому електроді (катоді) відбувається реакція відновлення: електрони (ē) з катода преходять до катіонів Гідрогену, при цьому утворюється газоподібний водень.
На позитивно зарядженому електроді (анода), відбувається реакція окиснення, при цьому утворються газоподібний кисень і електрони переходять від Оксигену до анода.
Катодний процес (відновлення): 2H+ + 2ē → H2↑
Анодний процес (окиснення): 2H2O → O2↑ + 4H+ + 4ē
Загальне рівняння: 2H2O → 2H2↑ + O2↑
 Промисловий електролізер води |
 Промисловий електролізер води |
7) Біотехнологічний спосіб (метод одержання водню за допомогою водоростей).

Виробництво водню за допомогою водоростей.
Водень зберігають у стальних балонах, які фарбують у зелений колір.

Балони з воднем
В лабораторії
1) Дія розбавлених кислот на метал. Для проведення такої реакції найчастіше використовують цинк та розбавлену хлоридну кислоту:
ВІДЕО: Добування водню
Переглянути відео
Цю реакцію проводять в апараті Кіппа. У середню частину апарату засипають цинк, а у верхню — заливають кислоту.

Апарат Кіппа.
ВІДЕО: Добування водню в апараті Кіппа
Переглянути відео
2) Взаємодія кальцію з водою:
ВІДЕО: Взаємодія кальцію з водою
Переглянути відео
3) Гідроліз гідридів:
ВІДЕО: Взаємодія кальцій гідриду з водою
Переглянути відео
4) Дія лугів на цинк чи алюміній:
ВІДЕО: Взаємодія Алюмінію з розчином натрій гідроксиду
Переглянути відео
ВІДЕО: Взаємодія цинку з розчином натрій гідроксиду
Переглянути відео
5) За допомогою електролізу. При електролізі водних розчинів лугів чи кислот на катоді відбувається виділення водню, наприклад:
ВІДЕО: Добування водню електролізом води
Переглянути відео
ПРОБА НА ЧИСТОТУ.
Пробірку перевернуту догори дном, заповнюють воднем, отвір закривають пальцем і підносять пробірку отвором до вогню. Чистий водень спалахує майже не чутно, водень з домішкою повітря займається з гучним звуком.
ВІДЕО: Проба водню на чистоту
Переглянути відео
Алотропія та ФІЗИЧНІ ВЛАСТИВОСТІ.
Водень — найлегший газ, він легший за повітря в 14,5 разів.
ВІДЕО: Демонстація густини водню
Переглянути відео
Очевидно, що чим менше маса молекул, тим вище їх швидкість при одній і тій же температурі. Як найлегші, молекули водню рухаються швидше молекул будь-якого іншого газу і тим швидше можуть передавати теплоту від одного тіла до іншого. Звідси випливає, що водень має найвищу теплопровідність серед газоподібних речовин. Його теплопровідність приблизно в сім разів вище теплопровідності повітря.
Молекула водню двоатомна — Н2. При нормальних умовах — це газ без кольору, запаху і смаку. Густина 0,08987 г/л (н. у.), температура плавлення -259,1 °C, температура кипіння -252,76 °C, питома теплота згоряння 120,9·106Дж/кг, малорозчинний у воді — 18,8 мл/л . Водень добре розчинний у багатьох металах (Ni, Pt, Pd тощо), особливо в паладії (850 об'ємів на 1 об'єм Pd). З розчинністю водню в металах пов'язана його здатність дифундувати через них; дифузія через вуглецевий сплав (наприклад, сталь) іноді супроводжується руйнуванням сплаву внаслідок взаємодії водню з вуглецем (так звана декарбонізація). Практично не розчинний в сріблі.
ВІДЕО: Горіння водню адсорбованого шматком паладію
Переглянути відео
Під дією електричного розряду водень випромінює світло.

Водень запаяний в скляній ампулі під тиском
декілька мілібар під дією
високочастотного розряду починає світитися.
Рідкий водень існує в дуже вузькому інтервалі температур від -252,76 до -259,2 °C. Це безбарвна рідина, дуже легка (густина при -253 °C — 0,0708 г/см3) і текуча.
Твердий водень, температура плавлення -259,2 °C, густина 0,0807 г/см3 (при -262 °C) — білосніжна маса. При високому тиску водень переходить в металевий стан.
Водень може бути, як відновником (в реакціях з неметалами, оксидами, органічними речовинами), так і окисником (в реакціях з металами).
Взаємодія з металами. Внаслідок нагрівання лужних та лужноземельних металів в атмосфері водню утворюються солеподібні речовини — гідриди.

Натрій гідрид (NaH).

Кальцій гідрид (CaH2).
Взаємодія з неметалами. Водень взаємодіє з багатьма неметалами. Залежно від активності неметалів реакція може відбуватись з різною швидкістю. Із фтором реакція відбувається за кімнатної температури і завжди з вибухом.
ВІДЕО: Взаємодія водню з фтором
Переглянути відео
З хлором в темряві та без нагрівання водень взаємодіє повільно, на світлі — швидше, під час нагрівання миттєво із вибухом. Водень добре горить в атмосфері хлору.
ВІДЕО: Взаємодія водню з хлором
Переглянути відео
Із бромом та йодом водень реагує дуже повільно.
ВІДЕО: Взаємодія водню з бромом
Переглянути відео
ВІДЕО: Взаємодія водню з йодом
Переглянути відео
Також активно водень реагує з киснем. Водень горить в атмосфері кисню.
ВІДЕО: Горіння водню на повітрі
Переглянути відео
ВІДЕО: Горіння водню в кисні
Переглянути відео
Платина та нікель є каталізаторами даної реакції.
ВІДЕО: Платина як каталізатор горіння водню
Переглянути відео
Суміш водню та кисню в об’ємному співвідношенні 2:1, чи водню та повітря — 2:5, — називають гримучим газом. Ця суміш при наявності ініціатора (нагрівання, наявність платини чи нікелю), вибухає.
ВІДЕО: Вибух «гримучого газу» в мильних бульбашках
Переглянути відео
ВІДЕО: Вибух «гримучого газу» в повітряній кульці
Переглянути відео
ВІДЕО: Вибух «гримучого газу» в бляшаній банці
Переглянути відео
ВІДЕО: Вибух «гримучого газу» в пластиковій пояшці під дією платини
Переглянути відео
Температура воднево-кисневого полум’я становить близько 3000 °C.
З багатьма неметалами водень реагує за високої температури (наприклад, із сіркою), за високої температури та тиску або наявності каталізатора (наприклад, з азотом).
ВІДЕО: Взаємодія водню з сіркою
Переглянути відео
ВІДЕО: Взаємодія водню з азотом
Переглянути відео
Із сажею водень взаємодіє при сильному нагріванні, утворюючи метан:
Взаємодія з оксидами та галогенідами металів.
За високих температур водень може відновлювати метали з оксидів.
ВІДЕО: Взаємодія водню з купрум(II) оксидом
Переглянути відео
А також з галогенідів:
Взаємодія з органічними речовинами. З органічними речовинами водень вступає в реакції приєднання за кратним зв’язком: подвійним чи потрійним. Такі реакції називаються реакціями гідрування.
Гідрування ацетилену
Гідрування триолеату
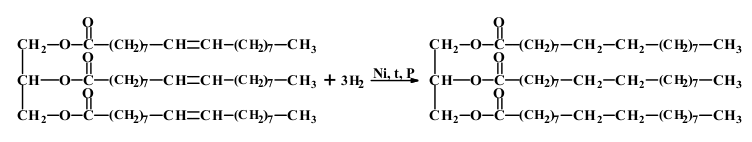
ВІДЕО: Взаємодія водню з оливковою олією
Переглянути відео
Атомарний водень (H) є значно активнішим за молекулярний (H2).
Водень використовують для наповнення дирижаблів та аеростатів.
Водень використовується при синтезі аміаку NH3, хлороводню HCl, метанолу СН3ОН, в гідрокрекінгу (крекінг у атмосфері водню) природних вуглеводнів, як відновник при отриманні деяких металів. Гідруванням природних рослинних олій отримують твердий жир — маргарин. Рідкий водень застосовується як ракетне паливо та як охолоджувач, оскільки має найвищу теплопровідність з усіх газів. Суміш кисню з воднем використовують при зварюванні металів.
Зареєстрований, як харчова добавка з індексом E949 (категрія «Інші добавки»). Передбачена функція добавки — пакувальний газ. Не дозволена в Україні.
Дейтерій та тритій застосовують у атомній енергетиці.
Використання дейтерію в техніці.
Дуже перспективним напрямком є використання водню як палива для двигунів нового типу, так званих паливних елементів. У США та в Європі вже існують водневі заправні станції, які забезпечують воднем автомобілі та автобуси, що на ньому працюють. Ця галузь називається воднева енергетика.

Авто на водні Ford Focus.

Перший пасажирський автобус на
водні.
Mercedes-Benz (DaimlerChrysler) Citaro Алдвих,
Лондон, 19 жовтня 2005.
Біологічна роль та фізіологічна дія
Гідроген як окремий елемент не має біологічної цінності. Для організму важливі сполуки, до складу яких він входить, а саме вода, білки, жири, вуглеводи, вітаміни, біологічно активні речовини (за винятком мінералів) і т. д. Найбільшу цінність, звичайно, представляє сполука Гідрогену з Оксигеном — вода, яка фактично є середовищем існування всіх клітин організму. Іншою групою важливих сполук Гідрогену є кислоти — їх здатність вивільняти йон Гідрогену робить можливим формування рН середовища. Важливою функцією Гідрогену також є його здатність утворювати водневі зв'язки, які, наприклад, формують в просторі активні форми білків і подвійну структуру ДНК.
Вміст Гідрогену в організмі дорослої людини становить близько 10% (7 кг на 70 кг маси тіла).
Водень не токсичний. Летальна доза для людини не визначена.